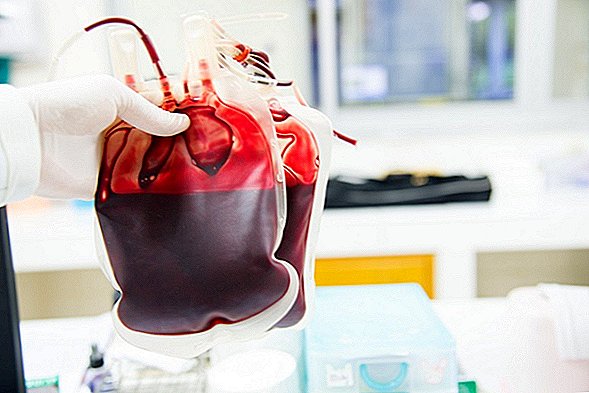
Om du tror att idén att få en överföring med "ungt blod" för att förhindra åldrande låter långtgående, ja, är amerikanska hälsotjänstemän eniga.
I dag (19 februari) sade den amerikanska livsmedels- och drogadministrationen (FDA) att det var bekymrat över rapporter om "dåliga aktörer" som erbjuder infusioner av blodplasma från ungdomar för att påstås behandla åldersrelaterade tillstånd och sjukdomar, en sådan minnesförlust, Parkinsons och Alzheimers sjukdom. Sådana behandlingar är inte bara obevisade, utan de har också potentiellt allvarliga risker, säger byrån.
"Enkelt uttryckt är vi oroliga för att vissa patienter pryteras av skrupelfria aktörer som visar behandling av plasma från unga givare som botemedel," säger Dr. Scott Gottlieb, FDA-kommissionär, och Dr. Peter Marks, chef för FDA: s Center for Biologics Evaluation and Research, sade i ett uttalande. "Sådana behandlingar har inga bevisade kliniska fördelar för de användningsområden som dessa kliniker annonserar för och är potentiellt skadliga."
Plasma är den flytande delen av blod och innehåller inte blodceller. Transfusioner med plasma kan vara livräddande för människor som upplever fysiska trauma eller som har vissa sjukdomar eller tillstånd som förhindrar deras blod från att koagulera ordentligt.
Men FDA har inte godkänt plasmatransfusioner för behandling av åldersrelaterade tillstånd och sjukdomar, och dessa behandlingar är inte kända för att vara säkra eller effektiva.
"Vi avskräcker starkt konsumenter från att fortsätta denna terapi utanför kliniska prövningar" som har fått lämplig granskning och tillsyn av lagstiftningen, sade Gottlieb och Marks.
Dessutom indikerar vissa rapporter att dessa icke godkända överföringar kan innebära stora volymer av plasma, och så stora doser är förknippade med "betydande risker", såsom infektioner, allergiska reaktioner och andnings- och kardiovaskulära problem.
FDA uppmanade konsumenterna att konsultera sina läkare innan de överväger sådana behandlingar. Dessutom måste kliniska prövningar som testar blodtransfusioner för ändamål som ännu inte godkänts av FDA ha en "ny undersökning av läkemedel (IND)" med FDA, vilket innebär att byrån har granskat den experimentella behandlingen för att se till att det är säkert . Så om blodtransfusionsterapi sägs erbjudas som en del av en klinisk prövning, bör människor be att se IND-numret och en kopia av FDA: s kommunikation som bekräftar ansökan, säger byrån.