Det tidiga 1900-talet var en mycket lyckosam tid för vetenskaperna. Förutom att Ernest Rutherford och Niels Bohr födde standardmodellen för partikelfysik, var det också en period med genombrott inom kvantmekanikens område. Tack vare pågående studier om elektroners beteende började forskare att föreslå teorier där dessa elementära partiklar uppträdde på sätt som trotsade klassisk, Newtons fysik.
Ett sådant exempel är den elektroniska molnmodellen som föreslagits av Erwin Schrodinger. Tack vare denna modell avbildades inte längre elektroner som partiklar som rör sig runt en central kärna i en fast bana. I stället föreslog Schrodinger en modell där forskare bara kunde göra utbildade gissningar om elektronernas positioner. Därför kunde deras platser bara beskrivas som en del av ett "moln" runt kärnan där elektronerna troligen hittas.
Atomfysik till 1900-talet:
De tidigaste kända exemplen på atomteori kommer från antika Grekland och Indien, där filosofer som Democritus postulerade att all materia var sammansatt av små, odelbara och oförstörbara enheter. Begreppet ”atom” myntades i det antika Grekland och gav upphov till tankeskolan känd som ”atomism”. Men denna teori var mer ett filosofiskt begrepp än en vetenskaplig.
Det var först på 1800-talet som atomteorin formulerades som en vetenskaplig fråga, med de första evidensbaserade experimenten som genomfördes. I början av 1800-talet använde till exempel den engelska forskaren John Dalton begreppet atom för att förklara varför kemiska element reagerade på vissa observerbara och förutsägbara sätt. Genom en serie experiment som involverade gaser fortsatte Dalton med att utveckla det som kallas Daltons Atomic Theory.
Denna teori utvidgade lagarna för konversation av massa och bestämda proportioner och kom till fem lokaler: element, i deras renaste tillstånd, består av partiklar som kallas atomer; atomer i ett specifikt element är desamma, ända fram till den sista atomen; atomer från olika element kan delas isär med sina atomvikter; atomer av element förenas för att bilda kemiska föreningar; atomer kan varken skapas eller förstöras i kemisk reaktion, bara grupperingarna ändras någonsin.
Upptäckten av elektron:
I slutet av 1800-talet började forskare att teoretisera att atomen bestod av mer än en grundläggande enhet. Men de flesta forskare vågade sig att denna enhet skulle vara storleken på den minsta kända atomen - väte. I slutet av 1800-talet skulle hans förändring drastiskt tack vare forskning som forskare som Sir Joseph John Thomson genomförde.
Genom en serie experiment med användning av katodstrålerör (känd som Crookes 'Tube) observerade Thomson att katodstrålarna kunde avledas med elektriska och magnetiska fält. Han drog slutsatsen att de snarare än att bestå av ljus, bestod av negativt laddade partiklar som var 1 gånger mindre och 1800 gånger lättare än väte.

Detta motbeviste effektivt tanken att väteatomen var den minsta materienheten, och Thompson gick vidare för att antyda att atomer var delbara. För att förklara den totala laddningen av atomen, som bestod av både positiva och negativa laddningar, föreslog Thompson en modell där de negativt laddade "kropparna" fördelades i ett enhetligt hav med positiv laddning - känd som Plum Pudding Model.
Dessa korpuskler skulle senare kallas "elektroner", baserat på den teoretiska partikeln som förutspåddes av den anglo-irländska fysikern George Johnstone Stoney 1874. Och härifrån föddes Plum Pudding-modellen, så benämnd på grund av att den liknade den engelska öknen som består av plommonkaka och russin. Konceptet introducerades till världen i mars 1904-upplagan av Storbritannien Filosofisk tidskrift, till bred hylla.
Utveckling av standardmodellen:
Efterföljande experiment avslöjade ett antal vetenskapliga problem med Plum Pudding-modellen. Till att börja med var det problemet med att visa att atomen hade en enhetlig positiv bakgrundsladdning, som blev känd som ”Thomson-problemet”. Fem år senare skulle modellen motbevisas av Hans Geiger och Ernest Marsden, som genomförde en serie experiment med alfapartiklar och guldfolie - aka. "guldfolieexperimentet."
I detta experiment mätte Geiger och Marsden spridningsmönstret för alfapartiklarna med en fluorescerande skärm. Om Thomsons modell var korrekt, skulle alfapartiklarna passera genom atomstrukturen i folien utan hinder. Emellertid noterade de istället att medan de flesta sköt rakt igenom, var några av dem spridda i olika riktningar, med vissa som gick tillbaka i riktning mot källan.

Geiger och Marsden drog slutsatsen att partiklarna hade stött på en elektrostatisk kraft som var mycket större än vad Thomsons modell tillät. Eftersom alfapartiklar bara är heliumkärnor (som är positivt laddade) antydde detta att den positiva laddningen i atomen inte sprids i stor utsträckning utan koncentrerades i en liten volym. Dessutom innebar det faktum att de partiklar som inte avböjdes passerade genom obehindrat att dessa positiva utrymmen separerades av vidsträckta bukter med tomt utrymme.
År 1911 tolkade fysikern Ernest Rutherford Geiger-Marsden-experimenten och förkastade Thomsons modell av atomen. Istället föreslog han en modell där atomen bestod av mestadels tomt utrymme, med all sin positiva laddning koncentrerad i dess centrum i en mycket liten volym, som var omgiven av ett moln av elektroner. Detta blev känt som atomens Rutherford-modell.
Efterföljande experiment av Antonius Van den Broek och Niels Bohr förfinade modellen ytterligare. Medan Van den Broek föreslog att atomantalet för ett element är mycket likt dess kärnkraftsladdning, föreslog den senare en solsystem-liknande modell av atomen, där en kärna innehåller atomantalet positiv laddning och är omgiven av en lika antal elektroner i orbitalskal (även Bohr-modellen).
Electron Cloud-modellen:
Under 1920-talet blev den österrikiska fysikern Erwin Schrodinger fascinerad av teorierna Max Planck, Albert Einstein, Niels Bohr, Arnold Sommerfeld och andra fysiker. Under denna tid blev han också engagerad i områdena atomteori och spektra och forskade vid universitetet i Zürich och därefter Friedrich Wilhelm-universitetet i Berlin (där han efterträdde Planck 1927).

1926 tog Schrödinger upp frågan om vågfunktioner och elektron i en serie papper. Förutom att beskriva vad som skulle bli känt som Schrodinger-ekvationen - en partiell differentiell ekvation som beskriver hur kvantsystemets kvantläge förändras med tiden - använde han också matematiska ekvationer för att beskriva sannolikheten för att hitta ett elektron i en viss position .
Detta blev grunden för vad som skulle bli känt som Electron Cloud (eller kvantmekanisk) modell, liksom Schrodinger-ekvationen. Baserat på kvantteori, som säger att all materia har egenskaper associerade med en vågfunktion, skiljer sig Electron Cloud Model från Bohr-modellen genom att den inte definierar den exakta banan för en elektron.
Istället förutsäger den den troliga positionen för elektronens placering baserat på en funktion av sannolikheter. Sannolikhetsfunktionen beskriver i grund och botten ett molnliknande område där elektronen troligen hittas, därav namnet. Där molnet är tätast är sannolikheten för att hitta elektronen störst; och där det är mindre troligt att elektron är, är molnet mindre tätt.
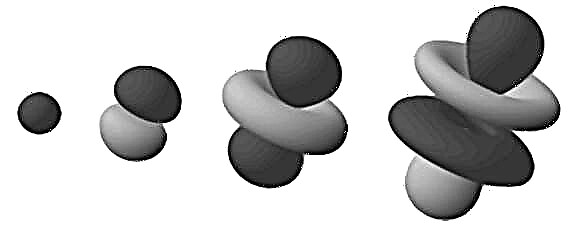
Dessa täta regioner är kända som "elektroniska orbitaler", eftersom de är den mest troliga platsen där en kretsande elektron kommer att hittas. Genom att utvidga denna "moln" -modell till ett tredimensionellt utrymme ser vi en skivstång eller en blomformad atom (som i bilden uppe). Här är de förgrenande regionerna de där vi mest troligt hittar elektronerna.
Tack vare Schrodingers arbete började forskare att förstå att det inom kvantmekanikens område var omöjligt att veta den exakta positionen och momentumet för en elektron på samma gång. Oavsett vad observatören inledningsvis vet om en partikel kan de bara förutsäga dess efterföljande placering eller fart när det gäller sannolikheter.
På ingen given tidpunkt kommer de att kunna konstatera någon av dem. Faktum är att ju mer de vet om en partikels momentum, desto mindre kommer de att veta om dess placering, och vice versa. Detta är vad som idag kallas ”Osäkerhetsprincipen”.
Observera att orbitalerna som nämns i föregående stycke är bildade av en väteatom (dvs med bara en elektron). När man hanterar atomer som har fler elektroner sprids elektronbanoregionerna jämnt till en sfärisk fuzzy boll. Det är här termen "elektronmoln" är bäst lämpad.
Detta bidrag erkändes allmänt som ett av 1900-talets kostnadsviktiga bidrag och som utlöste en revolution inom fysik, kvantmekanik och faktiskt alla vetenskaper. Därefter arbetade forskare inte längre i ett universum som kännetecknades av absolutiteter av tid och rum, utan i kvantosäkerheter och tidsrummet-relativitet!
Vi har skrivit många intressanta artiklar om atomer och atommodeller här på Space Magazine. Här är vad är John Daltons Atomic Model ?, What is the Plum Pudding Model ?, What is Bohr's Atomic Model ?, Who was Democritus ?, Och Vad är delarna av en Atom?
För mer information, se till Vad är kvantmekanik? från Live Science.
Astronomy Cast har också avsnitt om ämnet, som avsnitt 130: Radio Astronomy, avsnitt 138: Quantum Mechanics och avsnitt 252: Heisenberg Uncerurity Principle